HYDROGEN
Min kjemikerbakgrunn har sendt flashback fra et sted langt bak i hjernebarken: hydrogen, bindinger, elektronskall……. joda, det ligger der fortsatt.
Og no ska dåkker høre:

Øverst til venstre, først i det periodiske system finner vi Hydrogen, det letteste grunnstoffet i det periodiske system, det mest vanlige av alle grunnstoffer.
Vi har det i oss og rundt oss – hydrogen er overalt.

Plasseringen av stoffene det periodiske system er ikke tilfeldig. Hydrogen ligger øverst til venstre av en grunn.
Alle grunnstoff har en positivt ladet kjerne og en negativt ladet elektronsky rundt kjernen. Elektronskyene illustreres som skall rundt kjernene, akkurat som de russiske babuskadukkene – lag, på lag. I alle skallene er det plass til 8 elektroner, unntatt det innerste, det har bare plass til 2 elektroner.
Og Hydrogen og Helium som er de to minste grunnstoffene, har bare det innerste skallet med plass til 2 elektroner. Hos Hydrogen er det en plass ledig, det har bare et elektron, mangler et negativt elektron, og skrives derfor som H+. Helium derimot, vår letteste edelgass, den som kan gi morsom stemme, er nr 2 i det periodiske system, fordi det har 2 elektroner som danser rundt og lager elektronsky. Tenk på det som en tent stjernefyrstikk som veives rundt, det ser ut som en sprakende sirkel.

Helium står helt til høyre i det periodiske system. Hele høyre kolonne i det periodiske system er edelgasser. Dere husker regla: Hellige Neon Argon Kryper på Xenons Rand? Funket på mitt hode: Helium, Neon, Argon, Krypton, Xenon og Radon.
Felles for edelgassene er at det er fullt opp i deres ytterste skall, ingen ledige plasser. Og de kalles edelgasser fordi de er edle og rene, de vil helst ikke binde seg til andre stoffer, de er ikke så reaktive.

Hydrogen derimot, er rake motsetningen til Helium, Hydrogen vil veldig gjerne binde seg til andre stoffer, hydrogen er svært reaktivt.
Det ligger i stoffenes natur å ville fylle opp de ledige elektronplassene i skallene. Plasseringen i det periodiske system går på antall elektroner og hvor oppfylt disse skallene er.
Sånn, nå vet dere at Hydrogen lett på tråden. Og da kan dere sikkert gjette dere til hva som nå kommer……
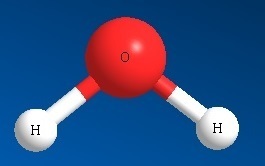
Jo, smuck, smuck så har Hydrogen bundet seg til et annet stoff. Og akkurat som hos oss, så går dette hett for seg når hydrogen binder seg til andre stoffer, og mye energi avgis. Denne effektive energibæreevnen er en av grunnene til at Hydrogen egner seg som drivstoff.
Den andre er at Hydrogen har et godt øye til Oksygen, de er reaktive begge to. Oksygen har 8 elektroner, 2 i innerste skall, så der er skallet fullt, og 6 i ytterste skall, altså 2 ledige elektronplasser. Oksygenet binder til seg 2 hydrogenatom og får dermed fylt opp sitt skall og er fornøyd og stabil. Det samme gjelder begge Hydrogenatomene, de får fylt opp sine ledige elektronplasser i skallene sine.
Når sluttproduktet av en reaksjon, energiproduksjon, er vann, H2O, er dette miljømessig å foretrekke framfor et sluttprodukt som CO2, som verden har skadelig for mye av.

Hvordan kan man få tak i denne villstyringen av en energibærer, for den finnes jo ikke naturlig i ren form, den er alltid bundet til et annet stoff?
Det finnes flere måter å produsere hydrogen:
- Fra olje, kull og naturgass. Prosessen er mye brukt, men har CO2 som biprodukt, mengder som vi må få ned, og ikke opp. Hydrogen produsert via sånne prosesser kalles GRÅTT hydrogen.
- Fra naturgass. Prosess som over, men biproduktet CO2 tas hånd om sånn at det ikke kommer i atmosfæren, feks i tomme oljelagre under havets bunn. Ut av synet, ute av sinn. Derfra kalles hydrogenet BLÅTT.
- For å få GRØNT hydrogen er prosessen vanligvis elektrolyse av vann, en slags omvendt batteriprosess der vannets oksygen og hydrogen spaltes til H2 og O2, fra flytende til gasser, der O2 er biprodukt.

Å produsere Hydrogen krever en del energi, men hvis man kan bruke noe energi for å produsere Hydrogen som energibærer – energilager for fremtidig bruk- i større mengder enn det som medgår for å produsere det, er det sikkert smart.
Kan man bruke energi som ellers ville gått til spille, feks restenergi fra andre produksjonsprosesser, eller potensiell energi fra vann og vind som enten ville gått til i havet eller til kråka, ville det være god ressursutnyttelse.

Miljøregnskapet gir jeg meg ikke ut på, men konstaterer at det er et mange-leddet regnestykke:
- Energitype og mengde som medgår for å produsere hydrogenet
- Biproduktene CO2 hvis råstoffet er olje, kull eller naturgass
- Energien som medgår til produksjon av hydrogenbrenselsceller
- Levetid til brenselcellene
- Transport og lagring
- Kraftunderskudd andre steder øker kullproduksjon og CO2-utslipp
- etc etc
Men om hydrogenproduksjon ikke gjør vondt verre for miljøet, og produksjonen bidrar til økt verdiskapning i samfunnet, så why not.
Økt produksjon, økt bruk, økt kunnskap, økt effekt, økt etterspørsel, lavere pris?

Det var dagens kjemileksjon fra MELLEM linjene.